El estrés calórico es uno de los problemas que causa mayores pérdidas económicas en las granjas avícolas de América Latina. Una gran mayoría de las granjas avícolas son abiertas y debido a esto es muy difícil realizar un buen control de las condiciones ambientales.
Como consecuencia el estrés calórico afecta prácticamente durante todo el año, no sólo en la época seca sino también en la época de lluvias, en la que además del calor, la alta humedad es un factor muy estresante para las aves. En general, se considera que el estrés calórico comienza cuando la combinación de la temperatura y la humedad relativa es superior al valor de 105.
Año tras año el estrés calórico golpea a nuestras granjas, y muchas veces no somos conscientes de las pérdidas económicas diarias que estamos teniendo como consecuencia de elevadas mortalidades, disminución de la producción, reducción de la calidad de nuestros productos y mayor susceptibilidad a padecer procesos patológicos por una disminución de la activación del sistema inmune.
Bajas como consecuencia del estrés calórico (foto del autor).
A la hora de poner remedios, como mejorar las instalaciones o aplicar determinados tratamientos a las aves, somos reacios al ver el dinero que cuestan estas medidas y en cambio no analizamos bien lo que ya estamos perdiendo. En mi opinión, una medida determinada, no hay que considerarla por el gasto inicial que representa, sino por lo que te puede devolver, es decir, el retorno de inversión.
Bajas por estrés calórico (foto del autor).
Las aves son una especie animal muy susceptible al estrés calórico y esto es muy difícil cambiarlo, al menos a corto plazo. Lo que sí tenemos que intentar es mitigar el estrés que sufre el ave, tanto con medidas de manejo como con tratamientos.
Una sola medida no va a solucionar el problema. Tenemos que combinar mejoras de manejo, mejoras de las instalaciones, medidas aplicadas en la dieta y tratamientos en el agua de bebida.
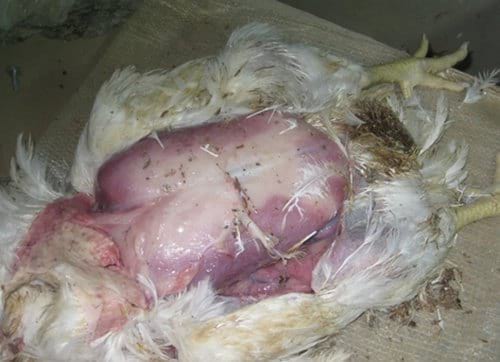
Necropsia de un broiler afectado por estrés calórico (foto del autor).
Presencia típica de cianosis en la piel.
La utilización de
ventiladores en las granjas avícolas afectadas por estrés calórico mitigan en cierto modo el estrés que sufre el ave, pero esta medida de manejo no soluciona el problema al 100%. Con frecuencia se observan aves postradas con hiperventilación a pesar de la presencia de
ventiladores. Por ello es muy importante realizar tratamientos vía agua de bebida, que son más efectivos que los tratamientos vía pienso, ya que la tendencia del ave bajo estrés calórico es la de disminuir el consumo de pienso para reducir la producción de calor endógeno.
Pollos postrados por calor a pesar de la presencia de ventiladores (foto del autor). A la hora de realizar un tratamiento en el agua de bebida, hay que recordar cuales son las alteraciones fisiológicas que padece el ave bajo estrés calórico:
- Hiperventilación que conduce inicialmente a alcalosis respiratoria.
- Pérdida de electrolitos (Na+, K+, Ca2+) en las deyecciones, que conduce a un desequilibrio electrolítico. La pérdida de calcio es importante en si misma ya que empeora la calidad de la cáscara, viéndose en las granjas un aumento de roturas y fisuras de huevos.
- Pérdida de agua intracelular que conduce a una deshidratación.
- Acidosis metabólica si persiste durante el suficiente tiempo el estrés calórico.
Cuando la combinación de Temperatura y humedad relativa es muy elevada, la única posibilidad que tiene el ave para disipar el calor es por medio de la hiperventilación. Esta hiperventilación genera inicialmente un aumento del pH o alcalosis respiratoria por exceso de bicarbonato.
Como respuesta, a nivel renal se aumenta la excreción de este bicarbonato junto con iones positivos como el Na+, K+ y Ca2+. Este aumento de la osmolaridad extracelular causa una pérdida de agua intracelular, lo que es compensado por un aumento en el consumo de agua del ave. El aumento en el consumo de agua no es suficiente como mecanismo compensatorio y se instaura una deshidratación, que es una de las causas principales de muerte en el caso de estrés calórico.
Se observa además en todo este proceso un aumento en el nivel de creatinina y aspartato-aminotransferasa, lo que indica un fallo renal y hepático.
Posteriormente a la alcalosis respiratoria, si el estrés calórico persiste, se instaura una acidosis metabólica como consecuencia de una reducción en el suministro de oxígeno a los tejidos, por una redistribución del flujo sanguíneo a la piel así como por la deshidratación. Con la acidosis metabólica, muchos órganos internos no pueden funcionar correctamente, y aparece pronto una insuficiencia renal, insuficiencia cardíaca, postración y muerte. La acidosis metabólica también es promovida por la pérdida constante de bicarbonato.
Por todo esto, para luchar contra el estrés calórico se pueden por un lado administrar electrolitos en el agua de bebida. Los principales electrolitos que se utilizan son el Bicarbonato Sódico (NaHCO3), el Cloruro de sodio (NaCl), el Cloruro Potásico (KCl) y el Cloruro de Amonio (NH4Cl). Estos electrolitos son beneficiosos ya que inducen un aumento en el consumo de agua, pero también dan lugar a la presencia de
camas húmedas, lo que puede llegar a ser perjudicial.
Hay que tener en cuenta que el Bicarbonato de Sodio, si bien ayuda a reducir la acidosis metabólica, en las fases iniciales del estrés calórico puede aumentar la alcalosis respiratoria y dar lugar a un aumento en la mortalidad.
Para evitar el problema de la aparición de heces pastosas al aplicar electrolitos, se puede administrar al mismo tiempo Betaína al agua de bebida. La Betaína, es un producto natural que se obtiene de algunas plantas como la remolacha, en las que actúa como osmorregulador. La Betaína actúa como un osmolito intracelular que compensa el diferencial electrolítico que se genera con la pérdida de agua y potasio en las aves y ayuda a mantener el balance hídrico celular evitando la deshidratación y reduciendo el daño tisular. Además, otra de sus ventajas es que este mecanismo necesita menos energía que el movimiento de iones por medio de las tradicionales bombas Na+ K+ ATPasas. Esta energía extra la puede usar el ave para fines productivos. No hay que olvidar también que la betaína tiene un efecto de protección de las células intestinales por su efecto osmorregulador, lo cual puede ser beneficioso en casos de coccidiosis y enteritis necrótica. Diversos autores han demostrado la efectividad de la Betaína en el caso del estrés calórico (Tabla 1).
Tabla 1. Efecto de la administración de betaína sobre los resultados productivos de broilers sometidos a estrés por calor desde los 19 a 48 días de edad.
Parámetro
| Control | Betaína vía agua |
| 0,05 % | 0,10 % |
Peso, g
| 2,240 | 2.292 | 2,326 |
Índice conversión
| 2,14 | 2,11 | 2,05 |
Supervivencia, %
| 84,9 | 93,8 | 98,0 |
La aplicación de Vitamina C también tiene un efecto beneficioso en el estrés calórico, al reducir los niveles de corticosteroides séricos y totales del ave, reduciendo por lo tanto el estrés y mejorando las variables productivas (Tabla 2). Los corticosteroides son los responsables de las respuestas compensatorias del ave estresada por calor, tales como la hiperventilación, el bombeo de sangre hacia zonas periféricas y la disminución de la actividad del sistema inmune (inmunosupresión). No hay que olvidar por ejemplo que la hiperventilación representa un gasto energético muy grande para el ave, consumiendo alrededor de 540 calorías para eliminar 1 gr de agua.
Tabla 2. Efecto de la administración de Vitamina C (ácido ascórbico) sobre la reducción de Corticosteroides plasmáticos y mortalidad en broilers afectados por estrés calórico. Thaxton y Pardue; 1984.
| Tratamiento | Sin calor | Con calor |
Ac. Ascórbico (mg/kg)
| 0 | 1000
| 0 | 1000
|
Corticosteroides plasmáticos (mg/ml)
| 2,4 | 2,4 | 22,0 | 7,3 |
Mortalidad (%)
| 3,2 | 4,9 | 18,1 | 8,8 |
También se ha descrito que productos antioxidantes pueden tener utilidad en el estrés calórico, como la adición de Zinc en la dieta o la administración de Vitamina E y Selenio. La administración de ácido acetilsalicílico también puede ayudar por su efecto vasodilatador, que puede mejorar la ventilación del ave, y compensar algo la acidosis metabólica.
Así no hay un único ingrediente que nos vaya a solucionar el problema del estrés calórico, sino una combinación de los mismos. Y no hay que olvidar que, para tener éxito al aplicar un producto en el agua de bebida, es importante que el agua sea de calidad y fresca. En este sentido el mentol es una sustancia natural que puede ayudar a hacer esta agua de bebida más apetecible.
Bibliografía:
- Bellés Medall, Santiago. (2005) Recursos prácticos a aplicar en las granjas de broilers contra el calor. Jornadas Profesionales de Producción de Carne, 25-27 abril. Real Escuela de Avicultura.
- Castelló José A. (2004) Efectos del calor sobre la puesta y la calidad del huevo. Selecciones Avícolas, Junio 2004:357-395.
- Ching, S. and Mahan, D.C. (2001). Ascorbic Acid Synthesis in Fetal, Nursing and Weanling Pigs. On-line bulletin of the Ohio State University. Research and Reviews: Swine. Special Circular 185-01. www.ohioline.osu.edu/sc185/sc185_5c.html
- Eccles, R. (2000) Role of cold receptors and menthol in thirst, the drive to breathe and arousal. Appetite 34: 29-35.
- McKee, J.S., Harrison, P.C. (1995) Effects of Supplemental Ascorbic Acid on the Performance of Broiler Chickens Exposed to Multiple Concurrent Stressors. Poultry Science, 74:1772-1785.
- Nowaczewski y Kontecka. (2005) Effect of dietary vitamin C supplement on reproductive performance of aviary pheasants. Czech J. Anim. Sci., 50(5): 208-212.
- Quiles, A., Hevia, M.L. (2005) Estrategias de manejo de gallinas en épocas de calor. Producción Animal 221: 41-51.- Remus, Janet. (2001) Betaine for increased breast meat yield in turkey. World Poultry- Elsevier 17(2):14-15.- Sahin, N., Onderci, M., Sahin, K., Gursu, M.F. and Smith, M. O. (2004) Ascorbic acid and melatonin reduce heat-induced performance inhibition and oxidative stress in Japanese quails. British Poultry Science 45(1):116-122.
- Veldkamp, T., Kwakkel, R. P., Ferket, P. R. and Verstegen, M.W.A. (December 2002) Impact of ambient temperature and age on dietary lysine and energy in turkey production. World''''s Poultry Science Journal, 58:475-491.
- Whitehead, C.C., Keller, T. (2003) An update on ascorbic acid in poultry. World''''s Poultry Science Journal 59:161-184.
- Farmacología Clínica en Aves Comerciales, cuarta edición. Héctor Sumano López. Cáp. 12. Bases farmacológicas del tratamiento del estrés calórico en aves.